上QQ阅读APP看书,第一时间看更新
第一节 概 述
20世纪60年代即开始有关新生儿呼吸衰竭体外循环支持的尝试,但当时由于采用早期心脏外科使用的氧合器,血液与空气直接接触达到氧合目的,使得运转2~3小时后即出现各种严重并发症。研究发现,此类氧合器造成严重血液破坏的最主要原因是血液与空气大面积直接接触。随着60年代开始将硅胶等材料研发应用于体外循环膜肺的制造中,使得使用人工心肺机和气血不直接接触的氧合器(或称人工肺)连续运转数天成为可能,继而长时间体外循环相关的生理和病理生理研究得以逐渐开展。
首例成功应用人工心肺机进行长时间生命支持的病例是在1971年由J Donald Hill及其团队完成。患者是一位患有急性呼吸窘迫综合征(ARDS)的青年男性。在当时,才刚刚将与肺炎、休克、创伤或脓毒血症并发的严重呼吸衰竭命名为ARDS,我们现在称为“重症医学”的学科也是在当时开始得到发展。有关长时间气管插管呼吸机辅助呼吸的临床应用在当时仅有10年历史,其临床价值也受到广泛质疑。在Hill的病例成功后,陆续报道了小儿和成人严重呼吸衰竭的成功抢救病例。1975年,美国国立健康研究院(NIH)主持了一项有关成人ARDS患者长时间体外循环支持抢救效果的多中心研究。这是历史上首次对一种研究终点为“死亡”的急性致死性疾病应用一种生命支持技术进行的前瞻性随机研究。该临床研究的设计和管理有很多问题,使得1979年发布的统计结果很不理想,但从其数据中仍然可以了解到,所有ARDS患者的总体死亡率为66%,严重ARDS的死亡率为90%。而在当时的条件下,由缺乏ECMO经验的医院和医护团队,单纯应用股静脉-股动脉ECMO(VA-ECMO)对患者进行呼吸支持1周,对严重ARDS患者的生存率提高并没有帮助。也就是在这个时期,体外循环长时间生命支持这一分支技术拥有了一个新的名称——“Extracorporeal Membrane Oxygenation,ECMO”,目前国内一般译为“体外膜肺氧合”或直接称为“ECMO”。随后,对成人呼吸衰竭进行ECMO中止了将近10年,但在新生儿呼吸衰竭治疗领域,ECMO技术却首先取得了成果。
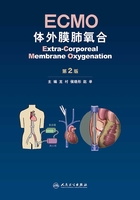
1975年,美国密歇根大学医学院Bartlett等成功对一名因胎粪吸入综合征导致呼吸衰竭的女性弃婴成功施行ECMO抢救成功。兴奋的医护人员将该无名婴儿命名为Esperanza,就是西班牙语“希望”的意思。该患者目前已经是一名健康快乐的母亲(图4-1)。
此后,新生儿呼吸衰竭ECMO获得了迅速发展,根据新生儿患者ECMO的早期数据,总体生存率在75%~95%。这些结果确立了对预计死亡率大于80%的婴幼儿进行ECMO支持的有效性。同时有多因素研究结果提示,ECMO技术对小于18岁的儿童接受肺移植期间是有益的。1986年,Bartlett发表了一篇对100例新生儿呼吸衰竭ECMO支持的报告,总体生存率为72%。英国的一项ECMO协作研究报告提到,ECMO支持降低了死亡风险而没有增加相关严重残疾的发生率。根据一项成功的Ⅰ期临床研究、两项成功的前瞻性随机化研究和世界范围内3万多例患者总体生存率为77%的事实支持下,ECMO成为传统治疗无效的新生儿呼吸衰竭的标准治疗方法。
患有严重肺实质损伤和气体交换功能受损的儿童患者也能从ECMO受益。严重呼吸衰竭常规治疗无效的儿童患者平均需要2周的ECMO,一些患儿甚至需要4~6周的ECMO才能恢复肺功能。1980年,Bartlett报道儿童和超过新生儿期的婴幼儿,出现严重呼吸衰竭,经传统治疗生存率<10%,经ECMO后生存率>30%。1996年,Green等根据来自小儿重症监护研究组关于ECMO对于小儿呼吸衰竭治疗效果的多中心研究报告,ECMO与传统治疗或高频通气等治疗相比可显著降低死亡率(生存率:ECMO组74% vs 对照组53%)。根据2012年7月ELSO的报告,进入ELSO数据库的因呼吸原因进行ECMO支持的患者人数超过51 000例,其中有超过50%(>25 000例)为新生儿呼吸衰竭。2000年以来,小儿呼吸衰竭接受体外生命支持系统的人数已经翻了一倍,每年都有超过350例进入ELSO数据库。由于其他治疗方法,如高频通气、吸入一氧化氮(NO)、人工肺泡表面活性物质等技术的进展,每年需要ECMO的新生儿人数有所降低,而小儿的数量则有所增加。

图4-1 Esperanza和Bartlett医生
A:ECMO支持下的Esperanza;B:成年后的Esperanza与Dr.Robert Bartlett
成人呼吸衰竭的ECMO支持在1979年NIH的报告发表后一度中断了10年。在NIH组织的该项研究中,原本计划观察300例患者,但仅进行90例后,研究即出于伦理目的而中止,因为ECMO组和对照组的死亡率都超过了90%。然而1986年,Gattinoni等报告对严重呼吸衰竭患者应用ECMO的生存率为49%。该结果激发了许多研究者的热情。对ECMO的适应证也修改为对全部传统呼吸机和药物治疗无效的可逆性呼吸衰竭,其预期死亡率超过80%。同时病肺可以预见在经过数天到数周的时间范围内通过体外循环支持有望恢复。尽管相关呼吸机技术和理论的进展、强效抗生素的研发,以及重症医学等都取得了相当的进步,但ARDS的死亡率仍居高不下。在美国,每年都有超过140 000人患上ARDS,其死亡率波动于22%~41%。目前的呼吸机辅助呼吸技术常常伴有高吸气相气道压(气压伤)、正常肺区域过度膨胀(容量伤)和吸入氧浓度达到毒性水平导致肺损伤加重(气压伤),表现为肺总顺应性、功能残气容积和动脉血气逐渐恶化。通过控制气道压力以避免呼吸机机械通气造成的气压伤与容量伤很快获得了广泛接受。已有多项研究(包括NIH组织的ARDS协作网研究)发现,小潮气量(TV=6ml/kg)呼吸机管理方法因减少对肺的牵拉可改善患者生存率。呼吸衰竭患者进行ECMO的根本目的是排出CO 2和交换O 2,从而可避免高潮气量和高气道压。
对成人可逆性呼吸衰竭很难进行明确界定,所以成人进行ECMO的标准也存在争议。许多人主张将氧合指数(PaO 2/FiO 2)<100作为标准,但应特别关注已经存在肺纤维化的患者。Bartlett则主张将肺体循环血流比(Q p/Q s)>30作为ECMO的适应证。ECMO对于气道高反应性疾病也非常有效,因为大部分支气管痉挛都是可逆性的,大部分死亡都与机械通气导致的并发症有关。急性呼吸衰竭需要ECMO支持的原因包括多种病因导致的原发性或继发性ARDS和气道高反应性疾病。感染脓毒血症导致呼吸衰竭曾经被认为是ECMO的禁忌证,但近年来认为脓毒血症或菌血症与患者生存率无直接关系,已经有多个报道对暴发性军团菌等严重感染导致的急性呼吸衰竭应用ECMO抢救成功。2009年发表的常规通气支持与ECMO治疗成人重型呼吸衰竭(conventional ventilation or ECMO for severe adult respiratory failure,CESAR)研究报告,通过对180例ARDS患者的随机对照研究发现,ECMO结合传统治疗方法治疗组生存率为63%,而单纯传统治疗组为47%。尽管对该研究的设计方法存在争议,但其研究价值仍得到承认。Lindn等对ARDS患者经ECMO之后的肺影像学、肺功能和生活质量进行了随访,发现大部分ECMO治疗后存活的ARDS患者具有较好的体力和社会能力,但即使出院1年后,仍表现有肺纤维化和轻度肺功能指标异常,大部分患者的生活质量有一定降低。2008年至2009年世界范围暴发流行重症非典型肺炎,ECMO在更大范围得到应用,使许多学者认识到其在危急重症患者中的治疗价值。
大部分传统治疗无效的严重呼吸衰竭成人患者,VV-ECMO是最佳选择,包括体外CO 2排出(ECCO 2R)和VV-ECMO。ECCO 2R通过低ECMO流量(接近1L)来进行CO 2排出,利用呼吸机低频正压通气(LFPPV)维持氧供。应用这种方法,氧供和CO 2排出是分离进行的。氧供主要是通过肺,而CO 2排出通过ECMO。如果肺不需要提供任何通气功能,即使是损伤最严重的肺仍然具有氧交换能力。这是ECCO 2R和“窒息性氧合”的理念,由Kolobow等和Gattinoni等发展而来。患者双肺中度压力(15~20cmH 2O)膨肺来维持功能残气容积,降低氧浓度,同时通过低流量部分VV-ECMO来进行CO 2排出。LFPPV-ECCO 2R体外循环流量为心排出量的20%~30%。血管入路采用联合应用颈静脉-股静脉,股静脉-股静脉或大隐静脉-大隐静脉。
VV-ECMO除了CO 2排出功能之外,强调氧合功能,体外循环流量较高(达到最大流量5L/min)来实现功能。患者呼吸衰竭更加严重并有较高的肺内分流时需要通过VV-ECMO提供更多的氧。Bartlett的一项94例回顾性研究中,成人患者VVECMO可通过经皮穿刺建立ECMO插管。VAECMO用于呼吸衰竭过程中出现心功能不稳定或功能衰竭不能维持足够心排出量的患者。VAECMO的主要弊病是需要在大血管进行插管,会降低肺血流,存在动脉血栓脱落危险,由于容量负荷过重进一步损伤左心室功能,循环只能依赖体外循环系统等。其有利之处在于不依赖于患者心功能来维持氧供。如果患者心功能改善,可将患者从VA-ECMO转为VV-ECMO。
与国际上各年龄段呼吸衰竭患者进行ECMO支持的临床实践与研究相比,我国除了台湾省、香港及澳门特别行政区外,在该领域均相对落后。2009年ECMO技术在新型甲型H1N1流感病例的呼吸支持上凸显出来的优势,使得目前国内已经有多家医院将ECMO技术应用于成人呼吸衰竭的救治,并取得初步成功,在一定程度上鼓舞了国内相关专业人员对ECMO技术的兴趣与信心。